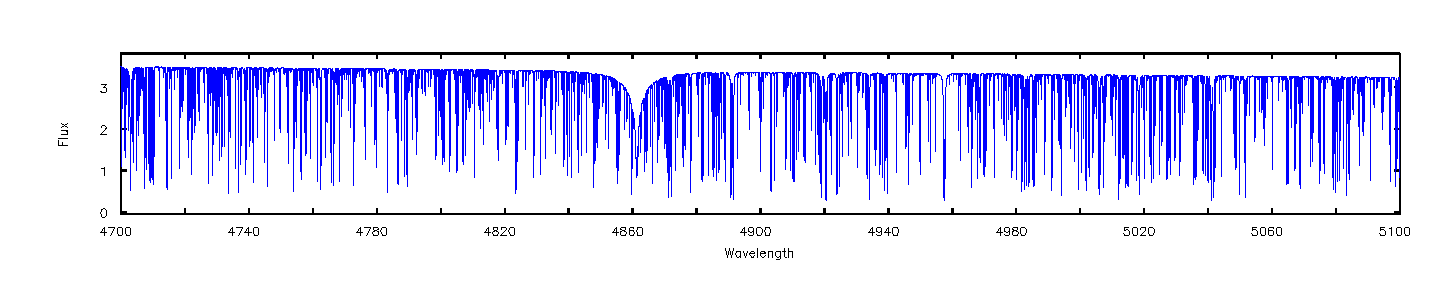
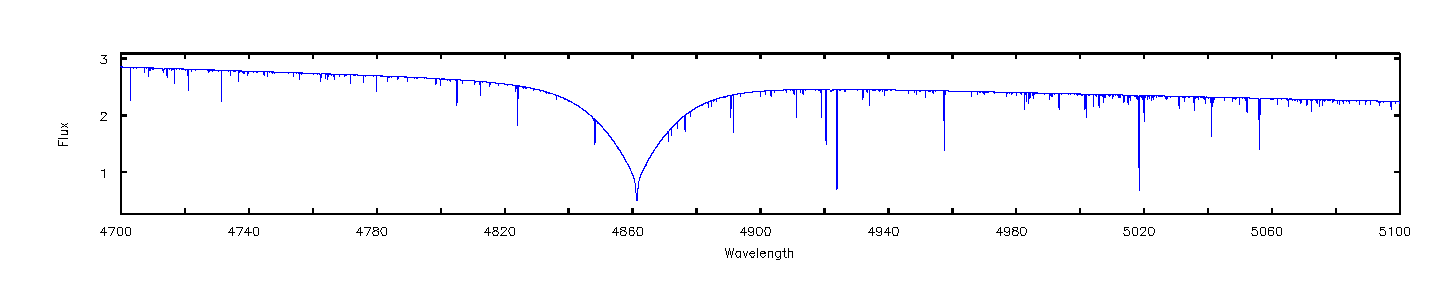
Sternspektren
| Licht kann als elektromagnetische Welle
beschrieben werden. Wechselnde elektrische und magnetische Felder, die
sich gegenseitig erzeugen wandern durch den Raum.
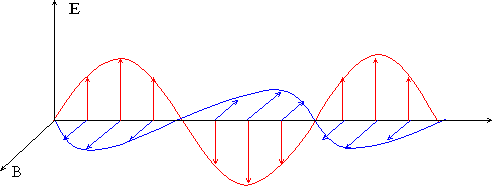
Zwischen der Wellenlänge l der Welle
und der Frequenz f der elektromagnetischen Schwingungen besteht die Relation
c = l× f
c ist die Ausbreitungsgeschwindigkeit der Welle, im Vakuum gilt c =
3,00× 108 m/s.
Die Farbe des Lichts wird durch die Frequenz f bestimmt. Weißes
Licht besteht aus einer Mischung von Licht verschiedener Frequenzen.
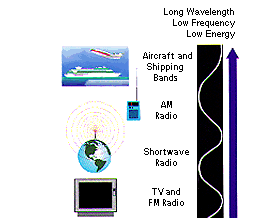
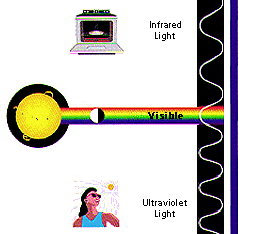
Licht, das wir mit unseren Augen wahrnehmen können, stellt nur
einen kleinen Ausschnitt des elektromagnetischen Spektrums dar, das zu
größeren Frequenzen hin erweitert über das Ultraviolett
bis zu Röntgenstrahlen, zu kleineren Frequenzen hin erweitert über
die Infrarot-Strahlung, Mikrowellen bis zu Radiowellen reicht. |
|
Spektrometer sind Geräte, mit denen man Licht (oder
andere elektromagnetische Wellen) in verschiedene Frequenzen (bzw. Wellenlängen)
aufspalten kann. Verwendet werden z.B. Gitter oder Prismenspektrometer.
Beim Prismenspektrometer nützt man die Eigenschaft, dass der Brechungswinkel
von der Frequenz (Farbe) des Lichts abhängig ist aus. Weißes
Licht spaltet in ein (sichtbares) Spektrum von rot bis blau auf.
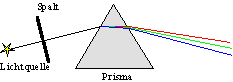
Bei Spektren unterscheidet man kontinuierliche Spektren und Linienspektren.
Heiße Körper zeigen ein kontinuierliches Spektrum, bei dem jede
Wellenlänge mit bestimmter von Null verschiedener Intensität
auftritt. Das Spektrum einer Glühlampe ist ein Beispiel dafür.
Bei Linienspektren treten nur ganz bestimmte Frequenzen auf.
Dabei unterscheidet man Emissionsspektren und Absorptionsspektren.
Zum Beispiel emittiert eine Natrium-Dampflampe im sichtbaren Bereich nur
wenige im gelben liegende Linien. (Emissionsspektrum). Schickt man aber
weißes Licht durch Natriumdampf und analysiert das durchgesandte
Licht mit einem Spektrometer, so stellt man fest, dass im kontinuierlichen
Spektrum des weißen Lichts nun genau die Linien fehlen, die im ersten
Versuch als Emissionslinien auftraten: Absorptionslinien, Absorptionspektrum.
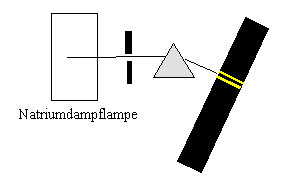
Emissionsspektrum
|
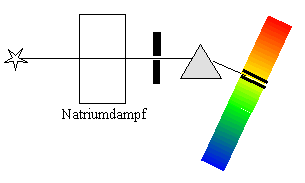
Absorptionsspektrum
|
Entstehung der Linienspektren:
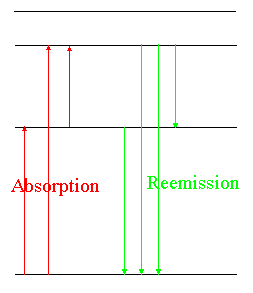
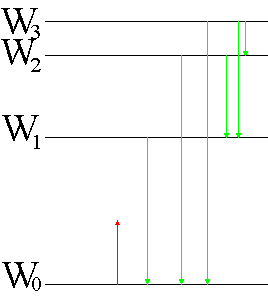
| Atome haben feste, voneinander getrennt Energiezustände. Der Zustand
mit der kleinsten Energie heißt Grundzustand, die Zustände mit
erhöhter Energie angeregte Zustände. Ein Atom kann also (z.B.
bei Stößen mit anderen Atomen) nur eine solche Energieportionen
aufnehmen, dass es von einem der erlaubten Energiezustände in einen
anderen wechseln kann.
Soll eine andere Energiemenge zugeführt werden, so kann das Atom
diese nicht aufnehmen. Stöße mit solchen Energien erfolgen daher
elastisch, d.h. ohne dass das Atom dabei Energie aufnehmen kann. Wir andererseits
eine passende Energiemenge angeboten, so kann das Atom die betreffende
Energie aufnehmen.
Atome, die sich in angeregten Zuständen befinden, können Energie
abgeben. Dabei kehren sie in den Grundzustand oder einen tiefer liegenden
angeregten Zustand zurück. Die Energieabgabe erfolgt i.a. durch Aussenden
von Licht. Je größer die ausgesandte Energie, um so größer
die Frequenz des ausgesandten Lichts.
Dass bei den Linienspektren nur bestimmte Frequenzen auftreten ist,
liegt also daran, dass das Atom nicht jede Energie, sondern nur ganz bestimmte
Energien besitzen kann. |
Die rot eingezeichnete Energiemenge kann nicht aufgenommen
werden. Die grünen Energiemengen können sowohl aufgenommen wie
abgegeben werden. |
Entstehung der Absorptionsspektren:
Von der Lichtquelle mit kontinuierlichem Spektrum werden alle Frequenzen
bzw. Energien angeboten. Das betrachtete Atom kann jedoch nur die Energien
aufnehmen, die durch die vorgegebenen Energieniveaus des Atoms bestimmt
sind. Diese Energien werden dann vom Atom auch wieder abgegeben.
Eigentlich sollten deshalb alle Frequenzen wieder auftreten und die
Absorptionslinien (d.h. das Verschwinden von bestimmten Frequenzen) ist
zunächst unklar.
 Allerdings muss noch beachtet werden, dass die Reemission der nicht
unbedingt in die gleich Richtung erfolgen muss, in der eingestrahlt wird,
sondern vielmehr statistisch verteilt ist. In die ursprüngliche Richtung
wird daher nur ein sehr kleiner Bruchteil der reemittierten Strahlung ausgesandt.
Für die zunächst absorbierten Frequenzen erhält man also
deutlich verringerte Intensitäten: Absorptionslinien.
Allerdings muss noch beachtet werden, dass die Reemission der nicht
unbedingt in die gleich Richtung erfolgen muss, in der eingestrahlt wird,
sondern vielmehr statistisch verteilt ist. In die ursprüngliche Richtung
wird daher nur ein sehr kleiner Bruchteil der reemittierten Strahlung ausgesandt.
Für die zunächst absorbierten Frequenzen erhält man also
deutlich verringerte Intensitäten: Absorptionslinien.
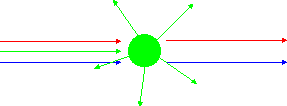
Absorption und Reemission von "grün".
Absorptionen aus angeregten Zuständen können nur erfolgen,
wenn bei der Absorption überhaupt (genügend) angeregte Atome
vorhanden waren. Da die angeregten Niveaus nur bei höheren Energien
besetzt sind, kann aus den Intensitäten dieser Absorptionslinien auf
Temperatur geschlossen werden.
Fraunhofer-Linien: Sind Absorptionslinien im kontinuierlichen
Spektrum der Temperaturstrahlung der Sonne /des Sterns. Durch die Zuordnung
der einzelnen Frequenzen zu Atomsorten erhält man Informationen über
Verteilung der chemischen Elemente in der oberen Sternschicht ("Chromosphäre").
Intensität und Breite der Linien, Linien von ionisierten Atomen,...
ergeben Aussagen über die Temperatur.
Historisches: Joseph von Fraunhofer (1814), Gitterspektrum der Sonne,
Absorptionslinien. 1868 Entdeckung des Helium aufgrund der Spektrallinien
(Janssen, Lockyer), 1895 erstmals als Element isoliert (Ramsay)
Sonne:
Wega:
Spektralklassen (1901)
Die Spektren verschiedener Sterne wurden in Klassen ähnlicher Spektren,
zunächst alphabetisch mit A;B;C bezeichnet, eingeteilt. Offensichtlich
wurden die Klassen mehrfach nach jeweils anderen Gesichtspunkten umsortiert,
bis man schließlich zur heute üblichen Reihenfolge der Spektralklassen
O B A F G K M gelangte. Eine feinere Einteilung hat noch jeweils Zwischenklassen
wie G0 G1 G2,... G9. Die Sonne hat ein Spektrum vom Typ G2.
Die effektive Temperatur nimmt mit fortschreitender Spektralklasse ab.
zum Index


![]()
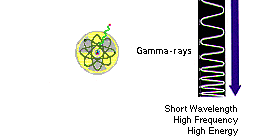



 Allerdings muss noch beachtet werden, dass die Reemission der nicht
unbedingt in die gleich Richtung erfolgen muss, in der eingestrahlt wird,
sondern vielmehr statistisch verteilt ist. In die ursprüngliche Richtung
wird daher nur ein sehr kleiner Bruchteil der reemittierten Strahlung ausgesandt.
Für die zunächst absorbierten Frequenzen erhält man also
deutlich verringerte Intensitäten: Absorptionslinien.
Allerdings muss noch beachtet werden, dass die Reemission der nicht
unbedingt in die gleich Richtung erfolgen muss, in der eingestrahlt wird,
sondern vielmehr statistisch verteilt ist. In die ursprüngliche Richtung
wird daher nur ein sehr kleiner Bruchteil der reemittierten Strahlung ausgesandt.
Für die zunächst absorbierten Frequenzen erhält man also
deutlich verringerte Intensitäten: Absorptionslinien.